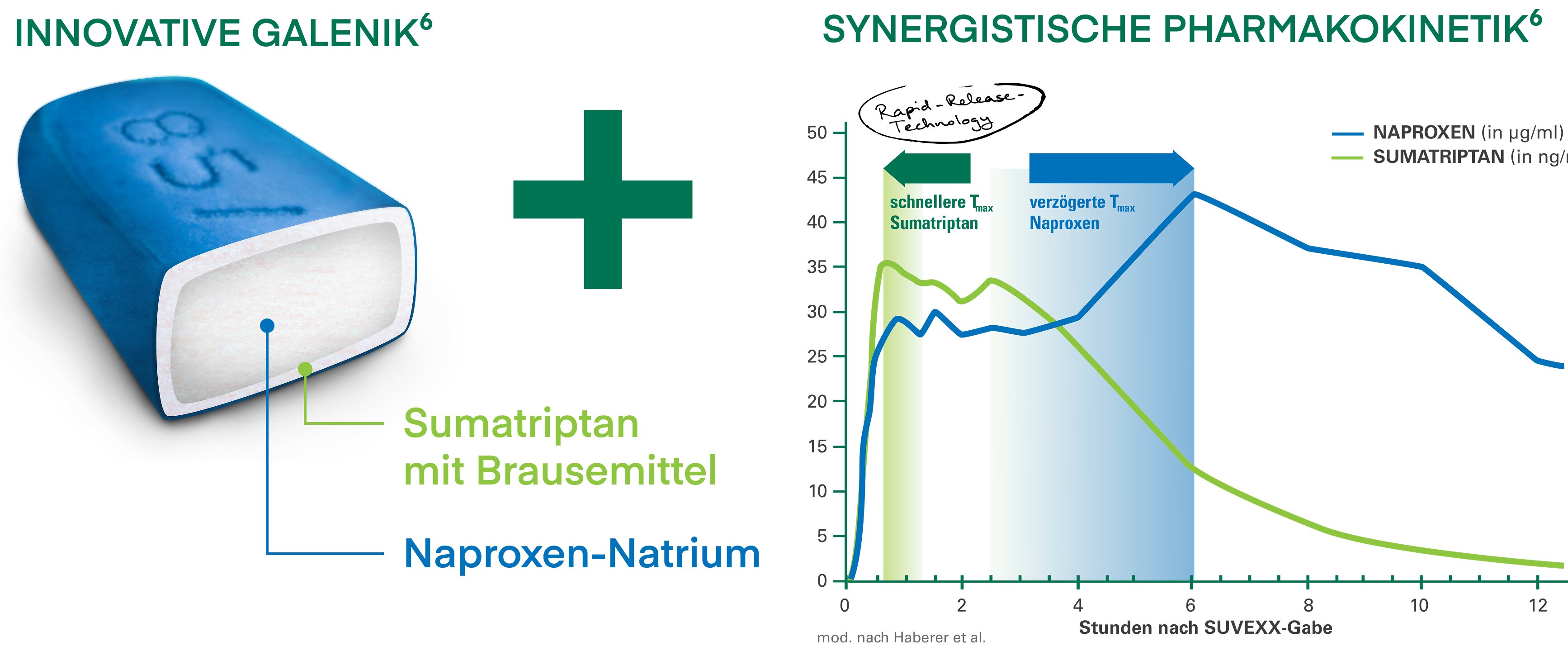
Zusammensetzung: Wirkstoffe: Jede Tablette enthält 119 mg Sumatriptansuccinat (entsprechend 85 mg Sumatriptan) und 500 mg Naproxen-Natrium (entsprechend 457 mg Naproxen). Sonstiger Bestandteil mit bekannter Wirkung: 60 mg Natrium. Sonstige Bestandteile: Calciumhydrogen-phosphat, Mikrokristalline Cellulose, Croscarmellose-Natrium, Natriumhydrogencarbonat, Povidon K30, Magnesiumstearat, Talkum. Überzug: Hypromellose, Titandioxid (E171), Triacetin, Indigokarmin-Aluminiumsalz (E132).
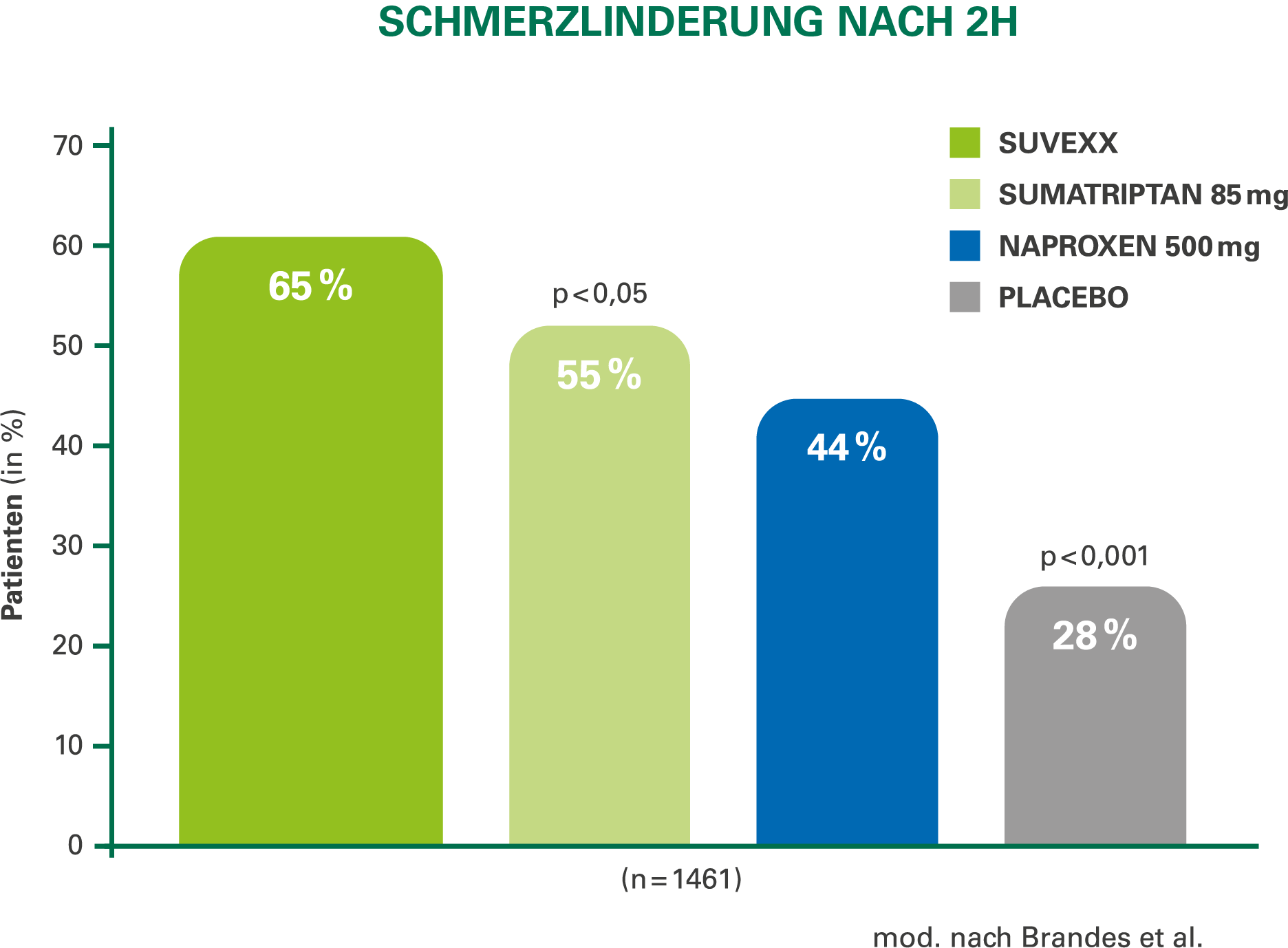
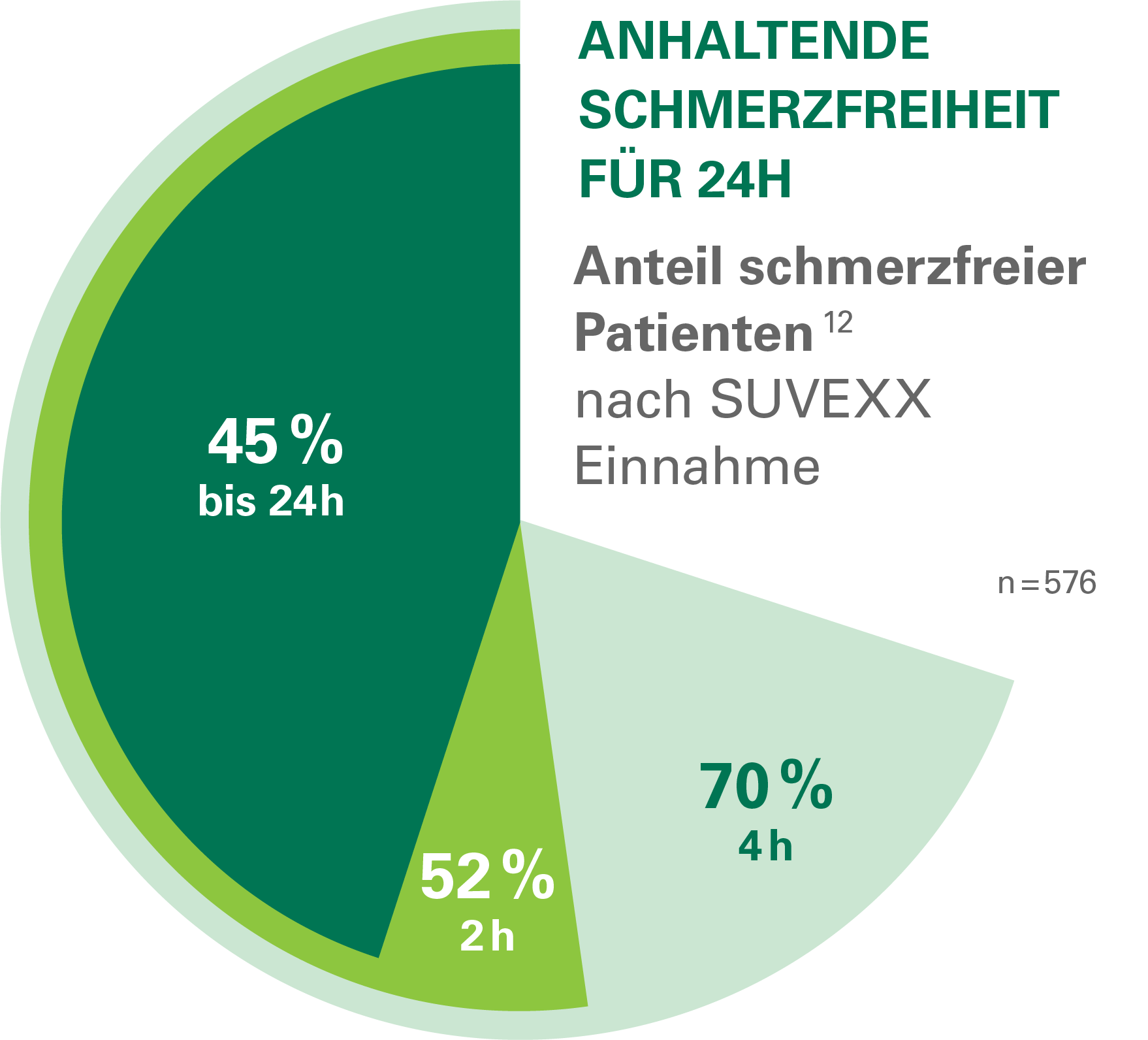
Anwendungsgebiete: Suvexx wird angewendet zur Akutbehandlung der Kopfschmerzphasen von Migräneattacken mit oder ohne Aura bei erwachsenen Patienten, bei denen eine Behandlung mit einem Arzneimittel, das nur einen Wirkstoff enthält, unzureichend ist.
Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Schwere Herzinsuffizienz, Myokardinfarkt in der Vorgeschichte oder ischämische Herzerkrankung, Koronarspasmus (Prinzmetal-Angina), periphere Gefäßerkrankungen. Ischämischer Schlaganfall oder transitorische ischämische Attacke (TIA) in der Anamnese. Überempfindlichkeitsreaktionen als Folge der Anwendung von Ibuprofen, Aspirin oder anderen NSAR. Blutungen im oberen Gastrointestinaltrakt oder Perforation in Verbindung mit einer vorangegangenen NSAR-Therapie. Akute peptische Ulzerationen oder gastrointestinale Blutungen oder rezidivierende vorangegangene Episoden. Mittelgradige bis schwere Hypertonie und leichte unkontrollierte Hypertonie. Schwere Nierenfunktionsstörungen. Mittelgradige bis schwere Leberfunktionsstörung. Gleichzeitige Einnahme von Ergotaminen oder Ergotaminderivaten oder anderer Triptane. Gleichzeitige Einnahme reversibler oder irreversibler MAO-Hemmer. Erste zwei Wochen nach Absetzen einer Behandlung mit MAO-Hemmern. Letztes Trimester der Schwangerschaft.
Warnhinweise und Vorsichtsmaßnahmen: Nur bei eindeutiger Migränediagnose anwenden. Nicht geeignet zur Anwendung bei der Behandlung von hemiplegischer, basilärer oder ophthalmoplegischer Migräne. Nicht empfohlen bei Patienten mit einer Familienanamnese oder Risikofaktoren für eine prädiktive Koronararterienerkrankung. Eine längere Anwendung bei älteren Patienten wird nicht empfohlen. Die Kombination von Suvexx mit anderen NSAR wird nicht empfohlen. Besondere Vorsicht bzw. Dosisanpassung ist bei folgenden Krankheiten oder Zuständen in der Anamnese erforderlich (Einzelheiten siehe Fachinformation): unbehandelte Hypertonie und leichte kontrollierte Hypertonie; Herzinsuffizienz; bestehende ischämische Herzerkrankungen einschließlich Risikofaktoren für ischämische Herzerkrankungen; periphere Arterienerkrankungen und/oder zerebrovaskuläre Erkrankungen einschließlich Risikofaktoren für kardiovaskuläre Ereignisse; gastrointestinale Erkrankungen; Gerinnungsstörungen; Krampfanfälle; Überempfindlichkeit gegenüber Sulfonamiden; Dehydrierung; Nierenfunktionsstörung; Leberfunktionsstörung; Bronchialasthma; Varicella; Einnahme anderer Arzneimittel, die ein erhöhtes Risiko von Ulzerationen oder Blutungen haben; gleichzeitige Einnahme von SSRI/SNRI; Einnahme anderer Arzneimittel, die die Hämostase beeinträchtigen; gleichzeitige Einnahme von Diuretika, ACE-Hemmern oder Angiotensin II-Rezeptor-Antagonisten.
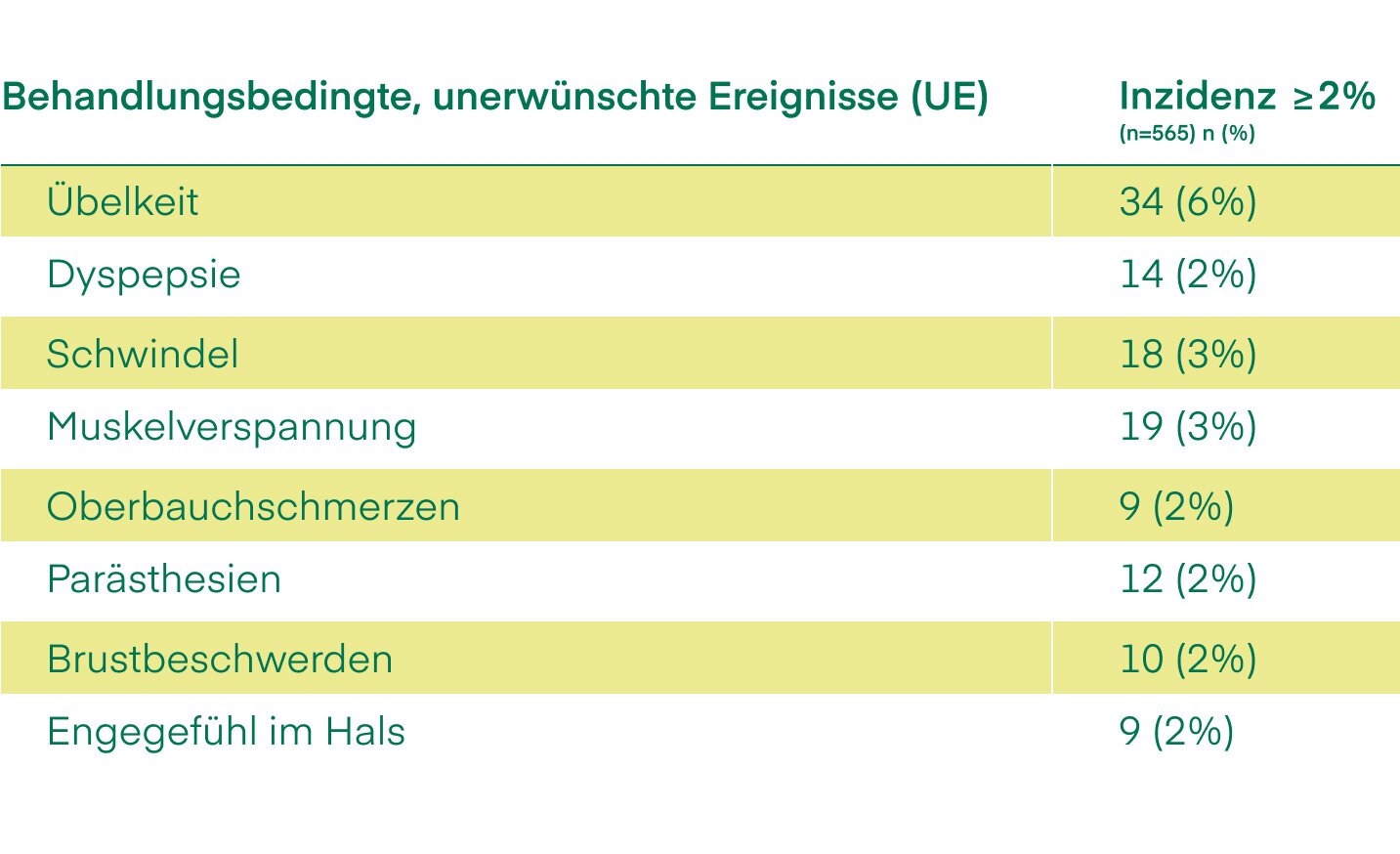
Nebenwirkungen: Sumatriptan. Häufig: Schwindel; Kribbeln; Schläfrigkeit; Sinnesstörungen; vorübergehender Anstieg des Blutdrucks; Hautrötung; Atemnot; Übelkeit; Erbrechen; Schmerzen; Hitze- oder Kältegefühl; Druck- oder Engegefühl; Schwächegefühl. Sehr selten: geringfügige Störungen des Leberfunktionstests. Häufigkeit nicht bekannt: Überempfindlichkeitsreaktionen; Angstzustände; Anfälle; Tremor; Dystonie; Nystagmus; Skotom; Augenflackern; Diplopie; vermindertes Sehvermögen; Verlust des Sehvermögens; Bradykardie; Tachykardie; Palpitationen; Herzrhythmusstörungen; vorübergehende ischämische EKG-Veränderungen; Koronararterien-Vasospasmus; Angina pectoris; Myokardinfarkt; Hypotonie; Raynaud-Syndrom; ischämische Kolitis; Diarrhoe; Dysphagie; Hyperhidrose; Nackensteifheit; Arthralgie; Schmerztrauma aktiviert; Schmerzentzündung aktiviert. Naproxen. Sehr häufig: Oberbauchschmerzen; Sodbrennen; Übelkeit; Obstipation. Häufig: Kopfschmerzen; Schwindel; Benommenheit; Sehstörungen; Tinnitus; Hörstörungen; Verschlechterung einer Herzinsuffizienz; Stomatitis; Diarrhoe; Erbrechen; Dyspepsie; Pruritus; Hautausschlag; Urtikaria; vermehrtes Schwitzen; Purpura; Ekchymose; Müdigkeit. Gelegentlich: Hyperkaliämie; Flüssigkeitsretention; Stimmungsschwankungen; Depression; Konzentrationsstörungen; kognitive Störungen; Schlaflosigkeit; Schlafstörungen; Krämpfe; Palpitationen; gastrointestinale Ulzera; Blutungen und/oder Perforationen; Hämatemesis; Melaena; Verschlimmerung von Colitis ulcerosa und Morbus Crohn; erhöhte Leberenzymwerte; Gelbsucht; Menstruationsstörung; Durst. Selten: Überempfindlichkeitsreaktionen; anaphylaktische Reaktion; angioneurotisches Ödem; Schwerhörigkeit; Lungenödem; Verschlimmerung von Asthma; toxische Hepatitis; Haarausfall; Lichtempfindlichkeit; Pseudoporphyrie; Myalgie; Muskelschwäche. Sehr selten: Eosinophilie; Thrombozytopenie; Leukopenie; Panzytopenie; hämolytische Anämie; aplastische Anämie; Agranulozytose; aseptische Meningitis; Verschlechterung der Parkinson-Krankheit; Vaskulitis; eosinophile Pneumonitis; Sialadenitis; Pankreatitis; Verschlimmerung von Lichen ruber; Verschlimmerung von Erythema nodosum; Verschlimmerung von Lupus erythematodes disseminatus (SLE); toxische epidermale Nekrolyse; Erythema multiforme; Stevens-Johnson-Syndrom; Hämaturie; Nierenversagen; Glomerulonephritis; interstitielle Nephritis; nephrotisches Syndrom; papilläre Nekrose. Häufigkeit nicht bekannt: Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS), fixes Arzneimittelexanthem, Pyrexie.
Verschreibungspflichtig. Zulassungsinhaber: Orion Corporation, Orionintie 1, FI-02200 Espoo, Finnland. Für Informationen zu diesem Arzneimittel wenden Sie sich bitte an den lokalen Vertreter des Zulassungsinhabers: Orion Pharma GmbH, Jürgen-Töpfer-Straße 46, 22763 Hamburg. Stand der Information: Dezember 2024